Thomas V. Inglesby, MD; Donald A. Henderson, MD, MPH; John G. Bartlett, MD; Michael S. Ascher, MD; Edward Eitzen, MD, MPH; Arthur M. Friedlander, MD; Jerome Hauegr, MPH; Joseph McDade, PhD; Michael T. Osterholm, PhD, MPH; Tara O’Toole, MD, MPH; Gerald Parker, PhD, DVM; Trish M. Perl, MD, MSc; Philip K. Russell, MD; Kevin Tonat, PhD; für die Arbeitsgruppe der zivilien Bioverteidigung
| Original | |
| Titel: | Anthrax as a Biological Weapon |
| Quellen: | JAMA 1999, 281:1735-1745 (Pubmed #10328075) |
| HTML: http://jama.jamanetwork.com/article.aspx?articleid=189876 | |
| PDF: http://jama.ama-assn.org/issues/v281n18/fpdf/jst80027.pdf |
Zusammenfassung
Vorhaben: Zusammenstellung von Empfehlungen für vorzunehmende Maßnahmen durch medizinisches Personal nach einem biologischen Angriff mit Milzbrand auf die zivile Bevölkerung.
Teilnehmer: Die Arbeitsgruppe umfaßt 21 Repräsentanten aus den größten medizinischen Zentren, der Regierung, dem Militär, der öffentlichen Gesundheit und den Notfallstellen.
Datenquellen: MEDLINE Datenbanken wurden für den Zeitraum von 1966 bis 1998 nach den Stichworten Anthrax, Bazillus anthracis, biologische Waffe, biologischer Terrorismus, biologische Kriegsführung und Biokriegsführung abgefragt. Die Durchsicht der Literaturhinweise diente dem Auffinden von Veröffentlichugen vor 1966. Darüberhinaus haben die Teilnehmer unveröffentlichte Quellen mit berücksichtigt.
Meinungsbildungsprozeß: Die erste Fassung des Konsensusdokumentes war eine Synthese der Informationen aus dem formalen Informationsfindungsprozeß. Alle Teilnehmer lieferten dazu schriftliche Komentare, die in die zweite Fassung eingearbeitet wurden. Die zweite Fassung wurde am 12.06.1998 durchgesehen. Es gab keine wesentlichen Meinungsverschiedenheiten und weitere Kommentare wurden in der dritten Fassung berücksichtigt. Die vierte und letzte Fassung umfaßt alle relevanten Quellen aus der Literaturrecherche in Verbindung mit den abschließenden Empfehlungen, die von allen Arbeitsgruppenmitgliedern unterstützt wurden.
Schlußfolgerungen: Es werden konkrete Empfehlungen zur Diagnose von Milzbrand, zum Einsatz von Impfungen, zur Therapie Infizierter, zur Prophylaxe nach Exposition und zur Dekontaminierung der Umgebung gegeben und auf weiteren Forschungsbedarf hingewiesen.
JAMA 1999, 281:1735-1745
Aus der Vielzahl an biologischen Agentien welche als Waffe benutzt werden könnten, hat die Arbeitsgruppe zur zivilen Bioverteidigung eine Auswahl getroffen welche dazu in der Lage wären durch Erkrankung oder Tod einer ausreichend großen Anzahl an Individuen eine Stadt oder Region lahmzulegen. Milzbrand ist einer der ernstzunehmenden aus dieser Gruppe.
Große Hoffnungen wurde einst in die von den meisten Ländern unterzeichneten Konventionen zu biologischen und chemischen Waffen gesetzt, welche offensive Forschungen zu Biowaffen oder deren Produktion verbietet. Jedoch der Irak und die ehemalige Sowjetunion, beides Unterzeichner der Konventionen, haben schrittweise zugegeben, daß sie Biowaffenprgramme für den Angriff haben; von einer Reihe weiterer Länder wird angenommen, daß sie ebenfalls solche Programme haben ebenso wie autonom agierende Terroristengruppen.¹
Bisher wurden biologische Agentien selten als Aerosol, der wahrscheinlichsten Möglichkeit zur breiten Streuung eines Erregers, verteilt. Aus diesem Grund gibt es wenig Erfahrungswerte über die potentielle Wirkung eines biologischen Angriffes oder über die Effizienz von Maßnahmen, wie Impfungen, antibiotische Therapie oder Quarantäne, nach einem Angriff. Die Richtlinien und Strategien beruhen daher auf der Interpretation und Extrapolation unvollständiger Daten. Die Arbeitsgruppe zur zivilen Bioverteidigung hat die vorhandene Literatur und Expertisen gesichtet und Empfehlungen für zu ergreifenden gesundheitspolitischen Maßnahmen nach einem solchen Angriff erarbeitet.
Meinungsbildungsprozess
Die Arbeitsgruppe umfaßt 21 Repräsentanten aus medizinisch-akademischen Zentren und der Forschung, der Regierung, dem Militär, der öffentlichen Gesundheit und den Notfallstellen.
MEDLINE Datenbanken wurden für den Zeitraum von 1966 bis 1998 nach den Stichworten Anthrax, Bazillus anthracis, biologische Waffe, biologischer Terrorismus, biologische Kriegsführung und Biokriegsführung abgefragt. Die Durchsicht der Literaturhinweise diente dem Auffinden von Veröffentlichugen vor 1966. Darüberhinaus haben die Teilnehmer unveröffentlichte Quellen aufgespürt.
Die erste Fassung des Konsensusdokumentes war eine Synthese der Informationen aus dem formalen Informationsfindungsprozess. Alle Teilnehmer wurden gebeten schriftliche Komentare zu dieser ersten Fassung im Mai 1998 abzugeben, die in die zweite Fassung eingearbeitet wurden. Die Arbeitsgruppe versammelte sich am 12.06.1998 am Johns Hopkins Center for Civilian Biodefense Studies, Baltimore, Md. zur überarbeitung der zweiten Fassung. Empfehlungen wurden ausgesprochen. Am Ende des Treffens gab es keine wesentlichen Meinungsverschiedenheiten und die auf der Konferenz vorgeschlagenen änderungen wurden in die dritte Fassung eingearbeitet, welche den Mitgliedern erneut zur Begutachtung und zu letzten Vorschlägen vorgelegt wurde. Die letzte Fassung umfaßt alle relevanten Quellen aus der Literaturrecherche in Verbindung mit den abschließenden Empfehlungen, die von allen Arbeitsgruppenmitgliedern unterstützt wurden. Die Kosten für die von der Arbeitsgruppe entwickelten Empfehlungen wurden primär durch die Institutionen der Teilnehmer getragen. Das Office of Emergency Preparedness, Department of Health and Human Services (DHHS) übernahm darüberhinaus für vier Teilnehmer die Reisekosten.
Die hier vorgelegten Einschätzungen und Empfehlungen sind nach bestem Wissen der Arbeitsgruppe an Hand der zur Zeit verfügbaren Daten und Expertisen gemacht worden. Die Schlußfolgerungen und Empfehlungen müssen regelmäßig überarbeitet werden, sobald neue Kenntnisse hinzukommen.
Historie
Über Jahrhunderte hinweg hat Milzbrand weltweit bei Tieren und, allerdings weniger häufig, zu schweren Erkrankungen beim Menschen geführt.² Die Forschung zum Einsatz von Milzbrand als biologische Waffe liegt mehr als 80 Jahre zurück.³ Heute wird von etwa 17 Nationen angenommen, daß sie biologische Angriffswaffenprogramme haben;⁴ es ist jedoch unsicher wie viele davon mit Milzbrand arbeiten. Der Irak hat die Produktion und den Einsatz von Milzbrand in Waffen bestätigt.⁵
Die meisten Experten stimmen darin überein, daß die Herstellung von einem tödlichen Milzbrandaerosol über die Fähigkeiten von Individuen oder Gruppen ohne den Zugang zu Biohochtechnologie hinaus geht. Jedoch könnten autonome, finanziell gut ausgestattete Gruppen mit entsprechenden Kontakten in der Lage sein, das für einen Angriff notwendige Material zu beschaffen. Eine Terroristengruppe, die Aum Shinrikyo, die für die Freisetzung von Sarin in einer tokioter U-Bahnstation in 1995 verantwortlich ist,⁶ hat an mindestens acht Stellen in Tokio Aerosole mit Milzbrand und Botulinus versprüht. Aus ubekannten Gründen führten die Angriffe jedoch nicht zu Krankheitsausbrüchen.⁷
Die versehentliche Freisetzung eines milzbrandsporenhaltigen Aerosols aus einer militärischen mikrobiologischen Einheit in Swerdlowsk im Jahre 1979 in der ehemaligen Sowjetunion die in mindestens 79 Fällen zu einer Milzbrandinfektion und zu 68 Todesfällen führte, hat das tobringende Potential eines Milzbrandaerosols aufgezeigt.⁸ Ein Milzbrandaerosol wäre nach der Freisetzung geruchlos und unsichtbar und hätte die Fähigkeit sich über viele Kilometer zu bewegen bevor es sich zerstreut.⁹ ¹⁰ Es gibt Hinweise, daß nach einer Aerosolfreisetzung im Freien, Personen in geschlossenen Räumen denselben Dosen ausgesetzt sein könnten, wie solche im Freien.¹¹
Im Jahre 1970 hat ein Expertenteam der Weltgesundheitsorganisation (WHO) abgeschätzt, daß es nach einer Freisetzung von 50 kg Milzbrand durch ein Flugzeug über einer städtischen Bevölkerung von 5 Millionen 250.000 Infizierte geben würde, von denen 100.000 bei Ausbleiben einer Behandlung sterben würden.⁹ In einem Bericht des US Congressional Office of Technology Assessment von 1993 schätzte man die Zahl der Toten zwischen 130.000 und 3 Millionen nach einer Aerosolfreisetzung von 100 kg Milzbrandsporen in Windrichtung auf die Gegend von Washington, DC — eine Todesrate die der einer Wasserstoffbombe nahe kommt oder sie sogar übertrifft.¹² Eine vom Centers for Disease Control and Prevention (CDC) vorgelegte Kostenkalkulation kam auf 26,2 Milliarden US-$ pro 100.000 exponierter Personen.¹³
Epidemiologie
Natürlich auftretender Milzbrand wird durch Kontakt mit Milzbrandinfizierten Tieren oder Tierprodukten erworben. Am häufigsten tritt die Erkrankung bei Pflanzenfressern auf, welche die Sporen vom Boden mit der Nahrung aufnehmen. Große Ausbrüche der Viehseuche bei Pflanzenfressern sind bekannt; 1945 starben im Iran bei einem Ausbruch 1 Million Schafe.¹⁴ Impfprogramme bei den Viehbeständen haben das Risiko einer tödlichen Erkrankung bei diesen Tieren drastisch vermindert.¹⁵ Jedoch werden Milzbrandsporen weiterhin weltweit in Bodenproben nachgewiesen.¹⁶⁻¹⁸
Der Mensch kann sich auf drei Wegen mit Milzbrand infizieren: durch Einatmen, über die Hautoberfläche und durch Verschlucken. Natürlich auftretende Milzbrandinfektionen beim Menschen durch Inhalation sind inzwischen sehr seltene Ereignisse. Historisch betrachtet waren Wollsortierer in industriellen Anlagen am meisten gefährdet. Zwischen 1900 und 1978 sind in den USA nur 18 Fälle bekannt geworden, wobei die Mehrzahl bei speziellen Risikogruppen auftrat, so bei Ziegenhaarwerken, Ziegenlederarbeitern, Wollarbeitern und Gerbern. Zwei der 18 Fälle traten im Laboratoriumsumfeld auf.¹⁹
Am häufigsten erfolgt die natürliche Infektion, mit ca. 2.000 gemeldeten Fällen pro Jahr¹⁸, über die Haut durch Kontakt mir milzbrandinfizierten Tieren. Zwischen 1944 und 1994 wurden in den USA 224 Fälle von Hautmilzbrand gemeldet.²⁰ Die größte bekannte Epidemie beim Menschen trat zwischen 1979 und 1985 in Simbabwe mit mehr als 10.000 Milzbrandfällen auf, wovon fast alles Hautmilzbrandinfektionen waren.²¹
Infektionen über den Magen-Darm-Trakt werden nur selten dokumentiert.¹⁸ ²² ²³ Jedoch sind gastrointestinale Ausbrüche aus Afrika und Asien bekannt.²⁴ Die gastrointestinale Infektion erfolgt durch Aufnahme von unzureichend gekochtem, kontaminiertem Fleisch und tritt als Mund-Rachen- und Unterleibsvariante auf.²² ²⁴⁻²⁷ 1982 traten 24 Fälle von oral-pharyngealen Milzbrand im ländlichen Norden Thailands nach dem Genuß von kontaminiertem Büffelfleisch auf.²⁴ Ebenfalls aus Northailand wurde 1987 von 14 Fällen mit gastrointestinalem Milzbrand beider Varianten berichtet.²⁵
Seit 1978 ist in den USA kein Fall von Milzbrand durch Inhalation mehr bekannt geworden¹⁹ ²⁰, so daß ein einzelner Fall heute bereits einen Alarm auslöst. Wie der Vorfall in Swerdlowsk 1979 gezeigt hat, wird nach einem Angriff mit Milzbrandaerosol Lungenmilzbrand für den größten Teil der Erkrankungen und für fast die gesamten Todesfälle verantwortlich sein.⁸ ²⁸ Im Falle eines Milzbrandausbruches, verursacht durch Aerosolfreisetzung, wäre Hautmilzbrand weniger häufig als Lungenmilzbrand, einfacher zu diagnostizieren, einfacher zu behandeln und ginge mit wesentlich weniger Todesfällen einher. Im Swerdlowskvorfall gab es keine Todesfälle unter den Patienten mit Hautmilzbrand.⁸ Nur wenig ist über die Risiken einer Infektion durch mit Milzbrandsporen kontaminierte Lebensmittel oder Wasser bekannt. Obwohl gastrointesrinale Infektionen von Menschen bekannt sind, sind experiementelle Infektionen an Primaten durch direkte gastrointesrinale Einträufelung von Milzbrandsporen fehlgeschlagen.²⁹
Mikrobiologie
Bacillus anthracis leitet sich vom griechischen Wort für Kohle — anthrakis — ab, da sich die Erkrankung schwarze, kohleänliche Geschwüre in der Haut auszeichnet. Bacillus anthracis ist ein aerober, grampositiver, unbeweglicher, sporenbildender Bazillus. Die flagellenlose vegetative Form ist mit 1-8 µm in der Länge und 1-1,5 µm in der Breite vergleichsweise groß. Die Sporengröße liegt bei ca. 1 µm. Die Sporen wachsen schnell auf allen gängigen Labormedien bei 37°C und bilden Kolonien welche an Bambus und ein zusammengerolltes Haar erinnern, ohne in Schafsagar eine Hämolyse zu zeigen (Abbildung 1). Theoretisch sollte die Indentifikation durch Form von Zelle und Kolonie einem erfahrenen Mikrobiologen leicht fallen, obwohl nur wenige Mikrobiologen außerhalb der Veterinärmedizin jemals eine Milzbrandkolonie, jenseits von Lehrbüchern gesehen haben.³⁰
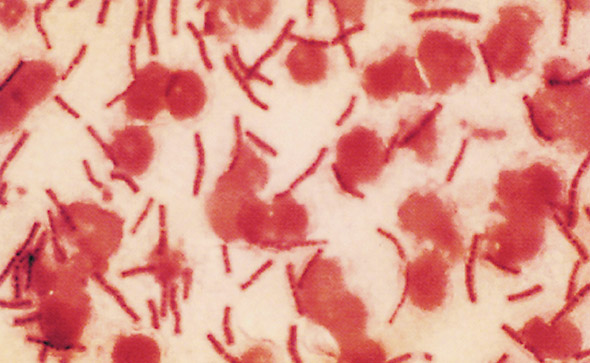
Abbildung 1: Gramfärbung von Bacillus anthracis Grampositive Milzbrandbazillen in einem Austrich von peripheren Blut eines Rhesusaffen der an Lungenmilzbrand gestorben ist. Nachdruck mit Genehmigung von Zajtchuk and Bellamy.²³
Milzbrandsporen beginnen zu keimen wenn sie sich in einem Medium welches reich an Aminosäuren, Nukleosiden und Glukose, wie es in Blut und Gewebe von Mensch und Tier gegeben ist, befinden. Im Gegensatz dazu bildet der sich schnell vermehrende vegetative Milzbrandbazillus nur dann Sporen, wenn die lokalen Nahrungsstoffe aufgebraucht sind, z.B. wenn milzbrandhaltige Körperflüssigkeiten der Umgebungsluft ausgesetzt werden.¹⁶ ¹⁷ Für die volle Virulenz von Milzbrand sind sowohl eine antiphagozytische Kapsel als auch drei Toxinkomponenten (protektives Antigen, ödemfaktor, Letalfaktor) notwendig.³⁰ Die vegetative Form hat außerhalb eines tierischen ode menschlichen Wirtes nur geringe überlebenschancen; Die Kolonienbildungsfähigkeit sinkt innerhalb von 24 Std. nach Einbringen in Wasser auf ein nicht mehr nachweisbares Niveau ab.¹⁷ Dies steht in krassem Gegensatz zu den Umgebungsansprüchen von Milzbrandsporen, die Jahrzehnte überdauern können.³⁰
Pathogenese und klinische Manifestationen
Lungenmilzbrand
Lugenmilzbrand entwickelt sich bei Ablagerung von sporenhaltigen Partikeln von 1-5 µm in den Lungenbläschen.³¹ ³² Makrophagen nehmen die Sporen von denen einige durch Lysis zerstört werden auf. überlebende Sporen werden über die Lymphwege zu den Lymphknoten des Mittelfells transportiert, wo bis zu 60 Tagen danach die Keimung einsetzten kann.²⁸ ²⁹ ³³ Es ist nur wenig über den Prozess der für die verzögerte Keimung verantwortlich ist bekannt, aber dafür sehr gut dokumentiert. Im Swerdlowskvorfall trat die Erkrankung zwischen 2 und 43 Tagen nach der Exposition auf.⁸ Bei Experimenten mit Affen trat eine tödliche Infektion bis 58²⁸ und 98 Tage³⁴ nach Exposition auf. Lebensfähige Sporen wurden bis zu 100 Tage nach Exposition in den Mittelfelllymphknoten der Affen nachgewiesen.³⁵
Nach Einsetzen der Keimung tritt rasch die Erkrankung auf. Die sich vermehrenden Bakterien setzen Toxine frei, die zu Blutungen, ödemen und Nekrosen führen.²³ ³⁶ In Tierversuchen tritt nach Erreichen eines kritischen Schwellwertes an Toxinen selbst dann der Tod ein, wenn die Sterilität des Blutes durch Antibiotika aufrecht erhalten werden kann.¹⁹ Basierend auf den bei Primaten gewonnenen Daten schätzt man die LD₅₀ (letale Dosis, die Dosis, bei der 50% der betroffenen Individuen sterben) für Menschen auf 2.500 – 55.000 eingeatmeter Sporen.³⁷
Der Ausdruck Inhalationsmilzbrand beschreibt die Art auf die die Infektion erfolgt. Der Ausdruck Lungenmilzbrand ist irreführend, da eine typische Bronchopneumonie nicht auftritt. Autopsien von Swerdlowsk-Patienten mit Lungenmilzbrand zeigten bei allen Fällen hämorrhagische thorakale Lymphadenitits und hämorrhagische Mediastinitis. In der Hälfte der Fälle wurde auch eine hämorrhagische Meningitis gefunden. Bei keiner der Autopsien wurden Anzeichen eines bronchoalveolaren pneumotischen Prozesses gefunden, obwohl 11 der 42 Fälle Anzeichen von punktförmigen hämorrhagischen, nekrotischen pneumotischen Läsionen ähnlich dem des Ghon-Herdes bei Tuberkulose zeigten.³⁸ Diese Ergebnisse stimmen mit anderen Reihenuntersuchungen und mit denen aus Tierversuchen mit induziertem Lungenmilzbrand überein.³³ ³⁹ ⁴⁰
Die frühe Diagnose von Lungenmilzbrand ist schwierig und benötigt starke Verdachtsmomente. Klinische Informationen sind nur von den 18 Fällen aus den USA in diesem Jahrhundert und von den nur begrenzt zur Verfügung stehenden Daten aus Swerdlowsk erhältlich. Der klinische Ablauf wurde als eine zweistufige Krankheit beschrieben. Die Patienten zeigten erst eine Reihe von uspezifischen Symptomen wie Fieber, Atembeschwerden, Husten, Kopfschmerzen, Erbrechen, Frösteln, Schwäche, Schmerzen in Abdomen und Brust.⁸ ¹⁹ Die Anzeichen der Erkrankung und Laboruntersuchungen sind unspezifischer Natur. Dieses Stadium dauerte von einigen Stunden bis zu einigen Tagen. Bei einigen Patienten folgte eine kurze Phase der Erholung, andere Patienten traten direkt in das zweite, fulminante Stadium der Erkrankung über.² ¹⁹ ⁴¹
Das zweite Stadium entwickelt sich abrupt, mit plötzlichem Fieber, Atemnot, Schweißausbrüchen und Schock. Eine massive Lyphadenopathie und Erweiterung des Mittelfells führte in einigen Fällen zu einem Stridor.⁴² ⁴³ Das Röntgenbild des Brustkorbes zeigt ein erweitertes Mittelfell, wie bei einer Lymphadenopathie zu erwarten (Abbildung 2).⁴² Bis zur Hälfte der Patienten entwickelte eine hämorrhagische Meningitis mit begleitendem Meningismus, Delirium und Abstumpfung. In diesem zweiten Stadium der Erkrankung schreitet eine Zyanose und Hypotonie rasch fort; der Tod tritt manchmal innerhalb von Stunden ein.² ¹⁹ ⁴¹
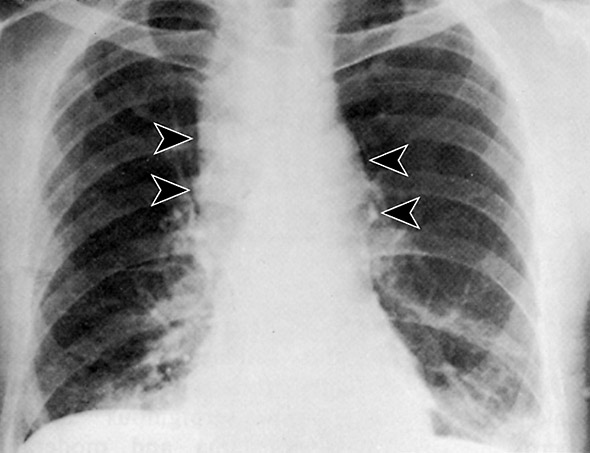
Abbildung 2: Röntgenaufnahme eines Patienten mit Lungenmilzbrand. Röntgenaufnahme des Brustkorbes eines 51jährigen Arbeiters nach beruflichem Kontakt mit Milzbrandsporen in der Luft, aufgenommen am 2. Tag der Erkrankung. Lobuläre Erweiterung des Mittelfells (Pfeile), in übereinstimmung mit einer Lymphadenopathie, mit kleinen parenchymalen Infiltraten in der linken Lungenseite. Nachdruck mit Genehmigung von Zajtchuk and Bellamy.²³
Die Sterberate bei Fällen bei beruflich erworbener Erkrankung liegt in den USA bei 89%, aber die Mehrheit der Fälle trat vor Entwicklung entsprechender Behandlungszentren und, in einigen Fällen, vor Erfindung der Antibiotika auf.¹⁹ In Berichten aus Swerdlowsk starben 68 der 79 Patienten mit Lungenmilzbrand, allerdings ist die Verläßlichkeit der Diagnose bei den überlebenden fraglich.⁸ Patienten bei denen die Erkrankung nach 30 oder mehr Tagen einsetzte, hatten eine höhere überlebensrate, als die der Früherkrankten. Antibiotika, Antianthraxglobulin und Impfungen wurden zwar in den betroffenen Gebieten nach der Freisetzung eingesetzt, aber welche Patienten welche Mittel erhalten hatten ist unbekannt. Bei schweren Fällen betrug der Zeitraum zwischen Auftreten der Symptome und Tod im Mittel drei Tage. Diese Ergebnisse stimmen mit dem Krankheitsverlauf aus Versuchen an unbehandelten Affen überein, die selbst nach einer Latenzzeit von 58 Tagen noch schnell eine tödliche Erkrankung entwickelten.²⁸
Die Sterberate bei den gegenwärtigen medizinischen Möglichkeiten und einer unterstützenden Therapie könnte niedriger liegen, als die bei den historischen Fällen. Allerdings sind die Erfahrungen aus Swerdlowsk nicht sehr hilfreich. Es wurden Antibiotika, Antianthraxglobulin, Kortikosteroide und künstliche Beatmung eingesetzt, jedoch wurden keine individuellen klinischen Daten nicht.⁸ Es ist weiterhin unsicher, ob der freigesetzte Stamm von B. anthracis überhaupt für das eingesetzte Antibiotikum empfänglich war.
Bei Tierversuchen wurden als physiologische Folgeschäden einer schweren Milzbrandinfektion Hypokalzämie, schwere Hypoglykämie, Hyperkaliämie, Paralyse der Atemorgane, Hypotonie, Anoxie, respiratorische Alkalose and terminale Azidose beschrieben.⁴⁴ ⁴⁵ Diese Ergebnisse lassen vermuten, daß zusätzlich zur raschen Gabe von Antibiotika die überlebensrate durch ständige überwachung und Korrektur des Elektrolythaushaltes, des Säure-Base-Gleichgewichtes, Glukoseinfusionen und frühe künstliche Beatmung und ADH-Regulation gesteigert werden kann.
Hautmilzbrand
Hautmilzbrand tritt nach Eindringen der Keime in die Haut auf, wobei Stellen mit kleinen Schnitten oder Abschilferungen besonders gutes Eindringen erlauben.²¹ ⁴⁶ Ungeschützte Hautpartien wie Arme, Hände, Gesicht und Nacken sind überwiegend betroffen. Es liegen keine Daten über eine eventuell verlängerte Inkubationszeit bei Hautmilzbrand vor. In Swerdlowsk traten Fälle von Hautmilzbrand erst recht spät 12 Tage nach der Freisetzung des Aerosols auf.⁸ Nach Beginn der Keimung der Sporen im Hautgewebe führt die Bildung des Toxins zu lokaler ödembildung (Abbildung 3). Anfangs ensteht ein juckender Fleck oder eine Pustel die sich im Verlauf des zweiten Tages zu einem runden Geschwür vergrößert. In der Folge können 1-3 mm große Bläschen entstehen, welche eine klare oder blutserumähnliche Flüssigkeit freisetzen, in der sich bei Gramfärbung viele Keime zeigen. Wie in Abbildung 3 entwickelt sich eine schmerzlose, schwarze Vertiefung, oft von einem ausgeprägtem lokalen ödem begleitet. Die Läsion trocknet ein, schwächt sich ab und verschwindet innerhalb von 1-2 Wochen und hinterläßt meistens keine bleibende Narbe. Lymphbahnentzündung und schmerzhafte Lymphadenopathie kann zusammen den dazugehörigen systemischen Symptomen auftreten. Obwohl eine antibiotische Therapie anscheinend den Verlauf und die Heilung der Geschwürbildung nicht ändert, vermindert sich dennoch die Wahrsceinlichkeit einer systemischen Erkrankung. Ohne antibiotische Therapie liegt die Sterberate bei 20%; mit Antibiotika sind Todesfälle bei Hautmilzbrand selten.²
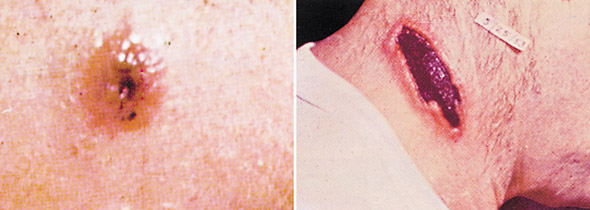
Abbildung 3: Hautmilzbrand
Links: Die Unterarmläsion am 7. Tag der Infektion mit Geschwür und Bläschen der ursprünglichen Milzbrandpapel Rechts: Geschwür am Hals am 15. Tag der Infektion, wie sie typisch für das letzte Stadium ist, bevor sie innerhalb der nächsten 1-2 Wochen verschwindet. Nachdruck mit Genehmigung von Binford CH, Connor DH, eds. Pathology of Tropical and Extraordinary Diseases. Vol 1. Washington, DC: Armed Forces Institute of Pathology; 1976:119. AFIP negative 71-1290-2.
Gastrointestinaler Milbrand (Darmmilzbrand
)
Darmmilzbrand tritt nach Eindringen und Keimung von Sporen im oberen und unteren Magen-Darm-Trakt auf. Ersterer führt zur oral-pharyngealen Form der Erkrankung.²⁴⁻²⁶ Bei Milzbrand in Mund oder Speiseröhre kommt es regional zu Lymphadenopathie, ödembildung und Sepsis.²⁴⁻²⁶ Letzterer führt primär zu Läsionen überwiegend im hinteren Teil des Krummdarmes und im Blinddarm³⁸, beginnend mit übelkeit, Erbrechen und Unwohlsein und rasch übergehend zu blutigem Durchfall, aktuem Abdomen oder Sepsis.²² In einigen Fällen wurde von großen Mengen Aszites (Bauchwasser) berichtet.²⁷ Das weiter fortgeschrittene Stadium kann der Sepsis bei Lungen- oder Hautmilzbrand ähneln.² Einige Autoren schlagen eine ähnlich konsequente medizische Behandlung wie sie für den Lungenmilzbrand empfohlen wird vor um die Sterberate zu vermindern, obwohl durch die Schwierigkeiten einer frühen Diagnose die Sterberate hoch bleiben wird.² ²²
Diagnose
Ausgehend von der Seltenheit einer Milzbrandinfektion und der Möglichkeit, daß frühe Fälle die Vorboten einer größeren Epidemie sind, müssen bereits erste Verdachtsfälle einer Milzbrandinfektion zu einer Meldung beim lokalen Gesundheitsamt, dem lokalen Krankenhausepidemiologen oder lokalen Untersuchungslabor führen. Dadruch können sehr schnell Vergleichstests durch ein Referenzlabor erfolgen und soweit notwendig durch das US Army Medical Research Institute of Infectious Diseases (USAMRIID), Fort Detrick, Md.
Der erste Hinweis auf eine verborgene Freisetzung von Milzbrand als biologische Waffe werden aller Wahrscheinlichkeit nach Patienten sein, die eine medizinische Behandlung auf Grund von Symptomen durch Lungenmilzbrand benötigen. Beim plötzlichen Auftreten einer großen Zahl von Patienten in einer Stadt oder Region mit akuten grippeähnlichen Anfangssymptomen und einer Sterberate von 80 oder mehr Prozent, mit nahezu der Hälfe aller Todesfälle innerhalb von 24-48 Std., wird es sich höchstwahrscheinlich um eine Milzbrand- oder Pneumonieepidemie handeln. Gegenwärtig gibt es kein effektives atmosphärisches Warnsystem um eine milzbrandsporenhaltige Aerosolwolke zu entdecken.⁴⁷
| Epidemiologie | Plötzliches Auftreten mehrerer Fälle schwerer grippeähnlicher Fälle mit heftigem Verlauf und hoher Todesrate |
| Diagnostik | Röntgenbild des Brustkorbes: Erweitertes Mediastinum Blutausstrich aus periphärem Blut: Grampositive Bazillen in nicht-zentrifugiertem Ausstrich |
| Mikrobiologe | Blutkultur von großen grampositiven Bazillen nach vorangegangener Identifikation der Spezies Bazillus |
| Pathologie | Hämorrhagische Mediastinitis, hämorrhagische thorakale Lymphadenitis, hämorrhagische Meningitis |
Schnelle diagnostische Tests für Milzbrand, wie ELISA (Enzyme-linked immunosorbent assay) für das protektive Antigen oder PCR (Polymerasekettenraktion) stehen nur nationalen Referenzlaboratorien zur Verfügung. In Anbetracht der begrenzten Verfügbarkeit von Tests und der für die Verteilung der Proben und zur Durchführung der Tests benötigten Zeit, würden schnelle diagnostische Tests nur für die Bestätigung und für die in vitro Bestimmung der Empfindlichkeit gegenüber Antibiotika in Frage kommen. Weiterhin würden diese Tests zur Untersuchung der Milzbrandfalschmeldungen, wie bei den Vorfällen Ende 1998 geschehen⁴⁸, eingesetzt werden. Auch würden sie bei der Untersuchung von milzbrandverdächtigem Material aus dem Besitz eines Terroristen wertvolle Dienste leisten.
Wenn nur einige wenige, gleichzeitige Fälle auftreten, kann die ähnlichkeit der klinischen Symptome von frühem Lungenmilzbrand mit anderen Erkrankungen des respiratorischen Systems zu einer um einige Tage verspäteten Diagnose führen. Jedoch kann die Diagnose von Milzbrand an Hand von ungewöhnlichen radiologischen Ergebnissen, mikrobiologischen Befunden oder spezifischen pathologischen Anzeichen bald offensichtlich werden. Ein im Röntgenbild erweitertes Mediastinum (Abbildung 2) von einem anfangs gesunden Patienten in Verbindung mit extensiven grippeähnlichen Symptomen ist ein klarer Hinweis auf Lungenmilzbrand und sollte sofort zu entsprechenden Maßnahmen führen.²³ ⁴² Obwohl eine Behandlung in diesem Stadium den Krankheitsverlauf in dem betroffenen Patienten wohl nicht mehr beeinflußt, könnte es zu einer früheren Diagnose bei Anderen führen.
Auch mikrobiologische Studien können B. anthracis aufzeigen und könnten die ersten Hinweise auf eine beginnende Epidemie sein. Wie bei Tierversuchen nachgewiesen, kann die baktrielle Beladung bei einer fortgeschrittenen Infektion so groß werden, daß eine Gramfärbung Bazillen in unzentrifugiertem Blut aufzeigen kann (Abbildung 1). Da es sich um ein beachtenswertes Ergebnis handelt könnte ein aufmerksamer Arzt oder Mikrobiologe zwar an Hand dessen eine Diagnose stellen, aber der weitverbreitete Einsatz von automatischen Zellzählern macht dies eher unwahrscheinlich.⁴¹
Der sinnvollste mikrobiologische Test ist die Standardblutkultur, welche innerhalb von 6-24 Std. Wachstum zeigen sollte. Ist das Labor über die Möglichkeit einer Milzbrandinfektion informiert, sollte anhand biochemischer Tests und der Kolonienmorphologie eine erste Vorabdiagnose 12-24 Std. später vorliegen. Eine abschließende Diagnose würde weitere 1-2 Tage für Tests in allen der wenigen nationalen Labors benötigen. Jedoch ist zu beachten, daß ohne den Verdacht auf Milzbrand B. anthracis eventuell nicht eindeutig identifiziert werden wird. Routinemäßig erbringen die Labors aus der Blutkultur zwar innerhalb von 24 Std. den Nachweis der Spezies Bacillus, aber in der Regel erfolgt keine weitere Typisierung, außer auf Anfrage. In den USA handelt es sich bei der Diagnose Bacillus meistens um Bacillus cereus. Labor und Arzt müssen sicherstellen, ob es sich bei seiner Isolierung um eine Probenverunreinigung handelt.⁴⁹ Aus den vergangenen 20 Jahren sind keine B. anthracis-Infektionen im Blut bekannt geworden. Im Falle eines biologischen Angriffs mit B. anthracis und der daraus resultierenden Notwendigkeit einer schnellen Diagnose, sollten die Laborabläufe sinnvollerweise dergestalt modifiziert werden, daß nach der Identifikation der Spezies BacillusB. anthracis explizit ausgeschlossen wird.
Die Verbindung von Sputumkultur und Gramfärbung hat auf Grund des Fehlens einer Pneumonie nur geringen diagnostischen Wert.³⁰ Bei Verdacht auf Hautmilzbrand kann eine Gramfärbung und Kultur der Vesikelflüssigkeit die Diagnose bestätigen.
Lungenmilzbrand kann auch postmortal nach einer schnellen, nicht-erklärbaren tödlichen Erkrankung diagnostiziert werden. Thorakale, hämorrhagisch nekrotisierende Lymphadenitis und hämorrhagisch nekrotisierende Mediastinitis bei einem anfangs gesunden Erwachsenen sind klar pathognomonisch für Lungenmilzbrand.³⁸ ⁴³ Ebenso sollte bei einer hämorrhagischen Meningitis der Verdacht auf Lungenmilzbrand aufkommen.²³ ³⁸ ⁴³ ⁵⁰ Ungeachtet der pathologischen Veränderungen bei Lungenmilzbrand wie sie bei einer groben Autopsie sichtbar wären, ist es auf Grund der Seltenheit von Milzbrand unwahrscheinlich, daß ein Pathologe die Ergebnisse sofort richtig zuordnen würde. Sollte die Diagnose bei der groben Autopsie nicht erfolgt sein, würden höchstwahrscheinlich weitere Tage vergehen, bis Gewebeschnitte für die mikrokopische Untersuchung zur Verfügung stünden um die Ursache der Erkrankung zu ergründen.
Impfung
Der US Milzbrandimpfstoff, ein inaktiviertes zellfreies Produkt, wurde 1970 zugelassen und wird von der Bioport Corp, Lansing, Mich (vormals Michigan Biologic Products Institute) hergestellt. Die zugelassene Applikation erfolgt in sechs Dosen und wurde kürzlich für das gesamte aktive Personal des US-Militärs und der Reserve als verbindlich vorgeschrieben.⁵¹ Der Impfstoff wird aus einem zellfreiem Filtrat von einem kapselfreien, abgeschwächten Stamm von B. anthracis hergestellt.⁵² Das immunitätsverleihende Hauptantigen ist das protektive Antigen.¹⁸ ²³ Ein ähnlicher Impfstoff hat sich in einer kleinen plazebokontrollierten Studie als ausreichend gegen Hautmilzbrand erwiesen.⁵³ Seit dem 1. März 1999 wurden etwa 590.000 Dosen Milzbrandimpfstoff von den US-Streitkräften verwaltet (Gary Strawder, Department of Defense, Falls Church, Va, mündliche Mitteilung, April 1999); es konnten keine schweren Nebenwirkungen ursächlich mit dem Impfstoff in Verbindung gebracht werden (Miles Braun, Food and Drug Administration, Rockville, Md, schriftliche Mitteilung, April 1999). Eine Impfung von Affen zum Zeitpunkt 0 und nach 2 Wochen, ergab vollständigen Schutz gegen Milzbrandaerosol nach 8 und 38 Wochen und 88%igen Schutz nach 100 Wochen.⁵⁴
Ein humaner abgeschwächter Lebendimpfstoff wird auf dem Gebiet der ehemaligen Sowjetunion produziert.⁵⁵ In der westlichen Welt wurden abgeschwächte Lebendimpfstoffe als nicht für die Verwendung am Menschen geeignet eingschätzt.⁵⁵
Die gegenwärtigen Impfstoffvorräte sind begrenzt und die US-Produktion ist mäßig. Es würde Jahre dauern bevor eine verstärkte Produktion ausreichende Mengen des Impfstoffes für den zivilen Gebrauch verfügbar machen würde. Auch wenn genügend Impfstoff zur Verfügung stünde, wäre eine groß angelegte Impfkampagne zu diesem Zeitpunkt nicht zu empfehlen wenn man die Kosten und die Logistik für ein solches Projekt und die geringe Wahrscheinlichkeit eines bioterroristischen Angriffes berücksichtigt. Bei Verfügbarkeit eines Impfstoffes sollte darüber nachgedacht werden notwendiges medizinisches Personal zu impfen. Sofern Impfstoff vorhanden ist, sollte eine Impfung nach einem Milzbrandangriff zusammen mit der Gabe von Antibiotika durchgeführt werden, um einen Schutz vor eventuell verbleibenden Sporen zu gewährleisten.
Therapie
Die Empfehlungen zur Verwendung von Antibiotika und Impfstoffen im Falle eines biologischen Angriffes mit Milzbrand sind durch die begrenzte Zahl an Untersuchungen in Tierversuchen, dem gegenwärtigen Verständnis der Antibiotikaresistenz und der Erfordernis gegebenenfalls eine große Zahl an Patienten zu behandeln eingeschränkt. Einige mögliche therapeutische Ansätze wurden experimentell erarbeitet oder sind zur Zulassung bei der FDA eingereicht. Aus diesen Gründen basieren die Konsensempfehlungen der Arbeitsgruppe auf den am besten zugänglichen Hinweisen. Die Empfehlungen entsprechen nicht den gegenwärtigen Zulassungen durch die FDA oder einer offiziellen Meinung irgendeiner Bundesorganistion von einer der an dieser Diskussion teilnehmenden Wissenschaftler und müssen bei Kenntnis weiterer Informationen angepaßt werden.
Da sich Lungenmilzbrand durch die schnelle Bildung von Symptomen auszeichnet, ist eine frühe antibiotische Therapie notwendig. Eine, selbst nur um Stunden verzögerte, antibiotische Behandlung von Milzbrandpatienten kann die überlebenswahrscheinlichkeit drastisch vermindern.⁵⁶ ⁵⁷ Auf Grund der Schwierigkeit einer schnellen mikrobiologischen Diagnostik von Milzbrand sollten alle Personen in einer Gegend mit Milzbrandfällen mit Fieber und Anzeichen einer systemischen Erkrankung solange antibiotisch behandelt werden, bis Milzbrand definitv ausgeschlossen werden kann.
Es gibt keine klinischen Studien zur Behandlung von Lungenmilzbrand beim Menschen. Daher wurden Richtwerte zur Antibiotikatherapie die normalerweise zur empirischen Behandlung einer Sepsis empfohlen werden für die vorliegende Situation nicht untersucht. Tatsache ist, daß natürlich vorkommende Stämme von B. anthracis gegen viele in diesen Richtlinien empfohlenen Antibiotika resistent sind, wie bspw. die aus dem erweiterten Spektrum der Cephalosporine.⁵⁸ ⁵⁹ Die meisten in Natur vorkommenden Milzbrandstämme sind empfindlich gegenüber Penizillin. Auch historisch ist Penizillin die bevorzugte Behandlung gegen Milzbrand. Von der FDA sind Penizillin und Doxyzyklin für diese Indikation zugelassen.⁴¹ ⁵⁶ ⁵⁷ ⁶⁰ In Studien mit wenigen Affen, infiziert mit empfindlchen Stämmen von B. anthracis, hat sich die orale Gabe von Doxyzyklin als ausreichend erwiesen.⁴¹
Von den Tetrazyklinen ist Doxyzyklin auf Grund seiner nachgewiesenen Wirksamkeit in Studien an Affen und seiner einfachen Handhabung das bevorzugte Antibiotikum. Andere Mitglieder aus dieser Antibiotikaklasse sind brauchbare Alternativen. Obwohl die Behandlung von Milzbrand mit Ciprofloxacin nicht beim Menschen untersucht worden ist, lassen Tiermodelle eine ausgezeichnete Wirkung vermuten²⁸ ⁴¹ ⁶¹ Aus in vitro Daten läßt sich ableiten, daß andere Fluorochinone eine gleichwertige Wirksamkeit bei der Behandlung von Milzbrand aufweisen würden, obwohl es jedoch keine Daten aus Tierversuchen mit anderen Fluorochinonen als mit Ciprofloaxacin gibt.⁵⁹
Es gibt Veröffentlichungen, zur Züchtung eines B. anthracis Impfstammes durch russische Wissenschaftler, der Tetrazyklinen und Penizillinen gegenüber resistent ist.⁶² Obwohl auch die Züchtung von fluorochinonresistenten B. anthracis möglich wäre, gibt es hierzu jedoch keine Veröffentlichungen.
Nach Abwägung von Effektivität zu Resistenzproblemen, kommt die Arbeitsgruppe zu der Empfehlung, daß Cirpofloxacin oder andere Fluorochinone das Mittel der ersten Wahl bei der Behandlung einer vermeintlichen Lungenmilzbrandinfektion sein sollten. Bei einem terroristischen Akt sollte von einer Tetrazyklin- und Penizillinresistenz ausgegangen werden, solange Laboruntersuchungen nichts gegenteiliges aufzeigen. Sobald es Aussagen zur Antibiotikasensitivität des B. anthracis-Stammes eines betroffenen Patienten gibt, sollte das Antibiotikum mit der größten Verbreitung, höchsten Effektivität und mit der geringsten Toxizität zur Behandlung von Patienten und zur postexpositionellen Prophylaxe verwendet werden.
In einer Situation mit einer moderaten Zahl betroffener Patienten empfiehlt die Arbeitsgruppe, wie in Tabelle 2 gezeigt, die intravenöse Applikation der Antibiotika. Im Falle einer großen Zahl Betroffener, geht die Arbeitsgruppe davon aus, daß eine intravenöse Therapie auf Grund von logistischen Problemen oder mangelnder Verfügbarkeit von Material oder Antibiotikum nicht mehr länger möglich ist und daher die Therpaie oral zu erfolgen hat (Tabelle 3). Der Schwellenwert bei dem eine parenterale Therapie unmöglich wird hängt von verschiedenen Faktoren, wie lokalen und regionalen Gegebenheiten des Gesundheitswesens ab.
| Initiale Therapieb | Optimale Therapie bei nachgewiesener Antibiotikaempfindlichkeit des Stammes | Dauer [Tage]c | |
|---|---|---|---|
| Erwachsene | Ciprofloxacin, alle 12 Std. 400 mg i.v. | Penicillin G, alle 4 Std. 4 Mio. Einheiten i.v. Doxyzyklin, alle 12 Std. 100 mg i.v.d | 60 |
| Kindere | Ciprofloxacin, 20-30 mg/kg i.v. pro Tag, verteilt auf zwei Dosen jedoch nicht mehr als 1 g/Tag | Alter < 12 Jahre: Penicillin G, alle 6 Std. 50.000 Einheiten i.v. Alter >= 12 Jahre: Penicillin G, alle 4 Std. 4 Mio. Einheiten i.v. | 60 |
| Schwangeref | wie nicht-schwangere Erwachsene | ||
| Immunsuprimierte Personen | wie bei nicht-immunsuprimierten Kindern und Erwachsenen | ||
| aViele Empfehlungen beruhen auf Daten aus Tierversuchen oder in vitro Studien und sind von der US Food and Drug Administration (FDA) zugelassen. Siehe Text zu Erklärungen und Alternativen.bIn vitro Studien legen als Ersatz für Ciprofloxacin alle 12 Std. 400 mg Ofloxacin i.v. oder alle 24 Std. 500 mg Levofloxacin i.v. nahe.cSobald verfügbar sollten oral applizierbare Antibiotika verwendet werden.dIn vitro Studien haben gezeigt, daß anstelle von Doxyzyklin auch Tetrazykline gegeben werden können.eDoxyzyklin kann ebenfalls verwendet werden. Kinder mit mehr als 45 kg wie Erwachsene behandeln. Bei Kindern mit oder weniger als 45 kg alle 12 Std. 2,5 mg/kg i.v. Siehe Angaben im Text.fSiehe Angaben im Text zu Schwangeren. | |||
| Initiale Therapieb | Optimale Therapie bei nachgewiesener Antibiotikaempfindlichkeit des Stammes | Dauer [Tage]c | |
|---|---|---|---|
| Erwachsene | Ciprofloxacin, alle 12 Std. 500 mg oral | Amoxicillin, alle 8 Std. 500 mg oral Doxyzyklin, alle 12 Std. 100 mg oralc | 60 |
| Kinderd | Ciprofloxacin, 20-30 mg/kg oral pro Tag, verteilt auf zwei Dosen jedoch nicht mehr als 1 g/Tag | KG >= 20 kg: Amoxicillin, alle 8 Std. 500 mg oral KG < 20 kg: Amoxicillin, 40 mg/kg aufgeteilt auf drei Dosen alle 8 Std. | 60 |
| Schwangeree | Ciprofloxacin, alle 12 Std. 500 mg oral | Amoxicillin, alle 8 Std. 500 mg oral | 60 |
| Immunsuprimierte Personen | wie bei nicht-immunsuprimierten Kindern und Erwachsenen | ||
|
aViele Empfehlungen beruhen auf Daten aus Tierversuchen oder in vitro Studien und sind von der US Food and Drug Administration (FDA) zugelassen. Siehe Text zu Erklärungen und Alternativen.bIn vitro Studien legen als Ersatz für Ciprofloxacin alle 12 Std. 400 mg Ofloxacin i.v. oder alle 24 Std. 500 mg Levofloxacin i.v. nahe.cdDoxyzyklin kann ebenfalls verwendet werden. Kinder mit mehr als 45 kg wie Erwachsene behandeln. Bei Kindern mit oder weniger als 45 kg alle 12 Std. 2,5 mg/kg i.v. Siehe Angaben im Text.eSiehe Angaben im Text zu Schwangeren. |
|||
In Tierversuchen hat eine antibiotische Therapie während einer Milzbrandinfektion die Entwicklung einer Immunantwort unterbunden.²⁸ ⁶² Das läßt vermuten, daß wenn antibiotikabehandelte Patiente überleben, sie für mindestens weitere 60 Tage auf Grund der Möglichkeit einer verzögerten Sporenkeimung gefährdet sind erneut an Milzbrand zu erkranken. Deshalb empfiehlt die Arbeitsgruppe eine Fortführung der antibiotischen Therapie für 60 Tage, wobei die intravenöse Applikationsform durch die orale ersetzt wird, sobald es die klinische Situation des Patienten zuläßt. Wenn denn eine breite Anwendung der Impfung gegeben ist, könnte eine postexpositionelle Impfung bei in Behandlung befindlichen Milzbrandpatienten die Dauer der antibiotischen Therapie auf 30-45 Tage reduzieren, bei gleichzeitiger Gabe von drei Dosen des Impfstoffes zu Zeitpunkten 0, 2 und 4 Wochen.
Traditionellerweise erfolgt die Behandlung von Hautmilzbrand mit Penizillin p.o. Die Arbeitsgruppe empfiehlt bei nachgewiesner antibiotischer Empfänglichkeit als wirksame Alternative zu den in Tabelle 2 und Tabelle 3 beschriebenen Dosierungen bei Erwachsenen die Behandlung mit Fluorochinolonen (p.o.) oder Tetrazyklinen, ebnso wie mit Amoxycillin. Obwohl bereits bestehende Richtlinien vorgeben Hautmilzbrand für 7-10 Tage zu behandeln²³ ⁴⁹, empfiehlt die Arbeitsgruppe im Falle eines Angriffs und dem angenommenen Kontakt mit dem primären Aerosol die Behandlung auf 60 Tage auszudehnen. Die Behandlung von Hautmilzbrand verhindert normalerweise das Fortschreiten zu einer systemischen Erkrankung, obwohl sie die Entwicklung und Ausbildung des Geschwürs nicht verhindert. Lokale Behandlung nicht sinnvoll.²
Andere in vitro wirksame Antibiotika gegen B. anthracis umfassen Chloramphenicol, Erythromycin, Clindamycin, Breitspektrum-Penizilline, Macrolide, Aminoglykoside, Vancomycinhydrochlorid, Cefazolin und andere Cephalosporine der ersten Generation⁵⁸ ⁵⁹ ⁶⁴ Die Wirksamkeit dieser Antibiotika wurder weder am Menschen noch an Tieren untersucht. Die Arbeitsgruppe empfiehlt, diese Antibiotika nur dann zu verwenden, wenn die vorher genannten Antibiotika nicht verfügbar sind oder die Stämme entsprechende Resistenzen aufweisen. Natürliche Resistenz von B. anthracis gegenüber Sulfamethoxazol, Trimethoprim, Cefuroxim, Na-Cefotaxim, Aztreonam und Ceftazidim kommt vor.⁵⁸ ⁵⁹ ⁶⁴ Deshalb sollten diese Antibiotika nicht länger zur Prophylaxe oder zur Behandlung einer Milzbrandinfektion eingesetzt werden.
Postexpositionelle Prophylaxe
Welche Personengruppen nach einem Milzbrandangriff eine postexpositionelle Prophylaxe erhalten sollen, muß von den Landes- und Lokalbehörden in Zusammenarbeit mit den nationalen Experten schnell ad hoc erarbeitet werden. Die Entscheidungen erfordern die Abschätzung zu Zeitdauer und Ort der Exposition sowie den relevanten Wetterbedingungen bei einer Freisetzung im Freien.⁶⁵ Wine weitergehende Beobachtung der Vorfälle zur Bestimmung von Hochrisikogebieten, eine direkte Verlaufskontrolle und eine Richtlinie zu Aufnahme in die oder Entlassung von Gruppen aus der postexpositionellen Prophylaxe sind ebenfalls notwendig.
Es gibt derzeit keine von der FDA zugelassenen Handlungsweisen für den Einsatz von Antibiotika nach Kontakt mit einem Milzbrandaerosol. Für die postexpositionelle Prophylaxe empfiehlt die Arbeitsgruppe dieselbe Vorgehensweise wie für die Behandlung bei einer Massenerkrankung; Die Prophylaxe sollte über 60 Tage anhalten (Tabelle 3).
Behandlung spezieller Personengruppen
Die hier vorgeschlagenen Empfehlungen für spezielle Personengruppen spiegeln die klinische und hinweisbasierte Beurteilung durch die Arbeitsgruppe wieder und stimmen gegenwärtig nicht unbedingt mit den von der FDA zugelassenen Indikationen oder Anweisungen überein.
Kinder
Es wurde empfohlen Ciprofloxacin und Fluorochinolene nicht an Heranwachsende zwischen 16 und 18 Jahren auf Grund der Assoziation einer permanenten Arthropathie in erwachsenen Tieren und einer transienten Arthropathie bei einer kleinen Anzahl Kinder zu verabreichen.⁶⁰ Anhand der zu erwartenden Risiken einer Milzbrandinfektion durch einen auf Antibiotikaresistenz gezüchteten Stamm empfiehlt die Arbeitsgruppe den Einstatz von Ciprofloxacin auch in dieser pädriatischen Gruppe als Initialtherapie und zur postexpositionellen Prophylaxe nach einer Milzbrandattacke (Tabelle 2). Wenn es Resistenzbestimmungen erlauben, sollten Fluorochinolene durch Penizillin ersetzt werden.
Als dritte Alternative kann Doxyzyklin verwendet werden. Die amerikanische Akademie der Pädiater hat empfohlen Doxyzyklin nicht bei Kindern unter 9 Jahren einzusetzen, da die Substanz bei Kindern und Heranwachsenden zu vermindertem Wachstum am Skelett und zu Verfärbungen an den Zähnen führt.⁶⁰ Unter Berücksichtigung der ernsten Risiken einer Infektion nach einem Milzbrandangriff gibt es übereinstimmung, daß Doxyzyklin dennoch bei Kindern eingesetzt werden kann, wenn Untersuchungen zur Resistenz, mangelnde Antibiotikavorräte oder auftretende allergische Reaktionen die Verwendung von Penizillin und Ciprofloxacin ausschließen.
Beim Auftreten von Einzelfällen, empfiehlt die Arbeitsgrupe bei Kindern die intravenöse Gabe von Antibiotika (Tabelle 2). Im Falle einer Massenerkrankung oder zur postexpositionellen Prophylaxe ist die orale Applikation von Antibiotika angezeigt (Tabelle 3).
Der US-Impfstoff ist nur bei Personen zwischen 18-65 Jahren zugelassen, da auch nur für diese Personengruppe entsprechende Studien durchgeführt worden sind.⁵² Für Kinder existieren keine Daten, aber anhand der Erfahrungen mit anderen Impfstoffen aus inaktiviertem Material, ist es wahrscheinlich, daß der Impfstoff sicher und wirksam ist.
Schwangere
Fluorochinolene sind während der Schwangerschaft auf Grund der bekannten Assoziation von Arthropathie in ausgewachsenen Tieren und bei einigen Kindern generell nicht zu empfehlen. Aus Tierversuchen gibt es keine Anhaltspunkte zur Teratogenität von Ciprofloxacin, aber es wurden bisher keine kontrollierten Studien dazu bei Schwangeren durchgeführt. Nach Abwägung dieser möglichen Risiken zu den Folgen einer Milzbrandinfektion mit gezüchteten, antibiotikaresistenten Stämmen empfiehlt die Arbeitsgruppe den Einsatz von Ciprofloxacin zur Therapie und postexpositionellen Prophylaxe in Schwangeren nach einem Milzbrandangriff. (Tabelle 2 und Tabelle 3). Es existieren keine geeigneten Untersuchungen zur Gabe von Penizillin oder Amoxyicillin in Schwangeren. Jedoch empfiehlt das CDC während der Schwangerschaft den Einsatz von Penizillin zur Behandlung von Syphilis und Amoxycillin zur Behandlung von Chlamydieninfektionen.⁶⁰
Die Arbeitsgruppe schlägt die Gabe von Fluorochinolenen an Schwangere in den für Erwachsene üblichen Dosierungen vor. Sofern es Suszeptibilitätsuntersuchungen erlauben, sollten Fluorochinolene durch Penizillin (i.v.) in den den für Erwachsene üblichen Dosierungen ersetzt werden. Als dritte Alternative läßt sich Doxyzyklin (.i.v.) verwenden. Die Gruppe der Tetrazykline wird sowohl mit toxischen Effekten in der Leber von Schwangeren als auch mit Vergiftungen des Fötus, einschließlich eines verminderten Skelettwachstums in Verbindung gebracht.⁶⁰ Nach Abwägung der Risiken einer Milzbrandinfektion verglichen mit denen einer Verwendung von Doxyzyklin in der Schwangerschaft empfiehlt die Arbeitsgruppe den Einsatz von Doxyzyklin zur Therapie und postexpositionellen Prophylaxe bei Schwangeren, wenn Untersuchungen zur Resistenz, mangelnde Antibiotikavorräte oder vorhandene Allergien die Verwendung von Penizillin und Ciprofloxacin ausschließen. Bei Verwendung von Doxyzyklin in Schwangeren, sollten, sofern möglich, kontinuierliche Leberfunktionstests durchgeführt werden.
Ciprofloxacin (und andere Fluorochinolene), Penizillin und Doxyzyklin (und andere Tetrazykline) werden in die Muttermilch sekretiert. Aus diesen Gründen sollte eine stillende Mutter mit demselben Antibiotikum wie ihr Kind behandelt werden, basierend auf der Enstscheidung größter Sicherheit und größten Erfolges für das Kind (siehe Terapie von Kindern) um das Risiko des Kindes zu minimieren.
Immunsupprimierte Personen
Eine antibiotische Therapie oder Impfung nach Exposition mit Milzbrand wurde bisher weder bei immunsupprimierten Personen noch in Tierversuchen untersucht. Deshalb empfiehlt die Arbeitsgruppe die Verabreichung von Antibiotika wie bei nicht-immunsupprimierten Erwachsenen und Kindern (Tabelle 2 und Tabelle 3).
Infektionskontrolle
Es liegen keine Daten vor, die darauf schließen lassen, daß eine Milzbrandübertragung von Mensch-zu-Mensch vorkommt.⁸ ⁴⁶ Bei stationären Patienten sollten dennoch für alle Formen einer Milzbrandinfektion die normalen Isolationsmaßnahmen vorgenommen werden. Allerdings ist die Verwendung von Masken mit hoch-effektiven Partikelfiltern oder anderen Luftschutzmaßnahmen nicht notwendig.⁶⁶ Auch ist es nicht notwendig die Kontaktpersonen (z. B. Haushaltskontakte, Freunde, Mitarbeiter) des Patienten zu impfen oder diesen eine Prophylaxe zu verabreichen, es sei denn, diese Personen waren dem Aerosol zum Zeitpunkt des Angriffs ebenfalls ausgesetzt.
Bei Verdacht auf Milzbrand sollten zusätzlich zur sofortigen Benachrichtigung des Krankenhausepidemiologen und des Gesundheitsamtes auch die lokalen mikrobiologischen Labors informiert werden, um eine sachgerechte Behandlung der Proben mit der biologischen Sicherheitsstufe 2 zu gewährleisten.⁴¹ ⁶⁷ Die im klinischen Bereich standardmäßig eingesetzten Desinfektionsmittel, wie Hypochlorit, sind auch für die Reinigung von mit infizierten Körperflüssigkeiten verunreinigten Oberflächen einsetzbar.¹⁷ ⁶⁶
Um eine weitere Ausbreitung der Erkrankung zu verhindern ist eine sachgemäße Bestattung oder Einäscherung von Menschen und Tieren die an Milzbrand gestorben sind notwendig. Eine Einäscherung sollte ernsthaft in Erwägung gezogen werden. Das Einbalsamieren von Körpern kann mit speziellen Risiken verbunden sein.⁶⁶ Wenn Autopsien durchgeführt worden sind, sollten die verwendeten Instrumente und Materialien autoklviert oder verbrannt werden.⁶⁶ Eine übertragung von Tieren auf den Menschen kann dann erfolgen, wenn infizierte zurückbleibende Tiere nicht verbrannt oder beerdigt werden.¹⁶ ²¹
Dekontaminierung
Die Empfehlungen zur Dekontaminierung im Falle einer absichtlichen Freisetzung eines milzbrandsporenhaltigen Aerosols basieren auf Erkenntnissen zur Aerosolbildung und überlebensfähigkeit von Milzbrandsporen sowie der Exposition der Umwelt beim Swerdlowskvorfall und bei Arbeitern von Ziegenhaarfabriken. Das größte Gesundheitsrisiko nach einer beabsichtigten Freisetzung von aerosolisierten Milzbrandsporen besteht während des Zeitraumes, in dem sich die Sporen noch in der Luft befinden, primäre Aerosolisierung genannt. Die Schwebedauer der Sporen und die Entfernung die von ihnen zurücklegt werden kann bevor sie ihre Infektiosität verlieren oder zu Boden sinken hängt von den meterologischen und aerobiologischen Eigenschaften des verteilten Aerosols ab.⁸ ⁶⁵ Unter Bedingungen von maximaler überlebensdauer und Persistenz, hätte ein Aersosol innerhalb 1 Stunde bis maximal 1 Tag seine größte Ausdehnung erreicht, d.h. lange bevor sich die ersten Symptome bemerkbar gemacht hätten. Nach der Erkenntnis, daß eine Biowaffe eingesetzt worden ist, könnten Milzbrandsporen mit Schnelltests oder durch Kultivierung auf Oberflächen nachgewiesen werden, allerdings liefern diese Methoden keine Information über das Risiko einer erneuten Aerosolbildung.
Das Risiko, daß Milzbrandsporen nach der primären Aerosolisierung die öffentliche Gesundheit noch weiter gefährden könnten läßt sich aus den Ergeignissen in Swerdlowsk, Untersuchungen in tierhaarverarbeitenden Fabriken und an Hand von Modellanalysen der US-Armee ableiten. In Swerdlowsk traten neue Fälle von Lungenmilzbrand bis zu 43 Tage nach dem angenommenen Zeitpunkt der Freisetzung auf, aber es gab Monate oder Jahre danach keine neuen Fälle.⁶⁸ Auch kam die Frage auf, ob die Fälle die nach einer Woche aufgetreten waren, nicht die Folgen einer Infektion nach Resuspendierung der Sporen vom Boden oder anderen Oberflächen sein könnten, einem Prozess der sekundäre Aerosolisierung genannt wurde. Auch wenn es unmöglich ist eine sekundäre Aerosolisierung mit Sicherheit auszuschließen, erscheint sie dennoch unwahrscheinlich. Auch muß man wissen, daß nach dem Unfall nur geringe Anstrengungen unternommen wurden die Umgebung zu dekontaminieren und nur 47.000 der 1 Million Einwohner geimpft wurden.⁸ Der epidemiologische Ablauf (Abbildung 4) ist typisch für eine Epidemie aus einer gemeinsamen Quelle, und für alle Patienten bestand zum Zeitpunkt des Unfalls die Möglichkeit des Aufenthaltes in dem betroffenen Gebiet. Außerdem wären mit Sicherheit auch nach 43 Tagen, wenn denn eine sekundäre Aerosolisierung eine Rolle gespielt hätte, weitere Fälle beobachtet worden.
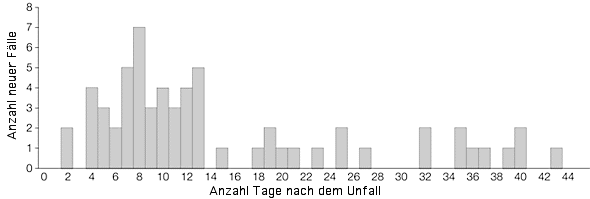
Abbildung 4: Auftreten von Lungenmilzbrand im Vorfall von Swerdlowsk. Die Abbildung basiert auf Daten von Guillermin.⁶⁸
Obwohl von Personen die mit Tierhaaren oder Fellen arbeiten bekannt ist, daß sie ein höheres Risiko haben an Lungen- oder Hautmilzbrand zu erkranken, erkrankten tatsächlich in den USA überraschenderweise nur einige von ihnen. Während der ersten Hälfe dieses Jahrhunderts war aller Wahrscheinlichkeit nach eine signifikante Zahl von Arbeitern in Ziegenhaarfabriken sporenhaltigen Aerosolen ausgesetzt. Erst in den sechzigerJahren wurde eine Impfung bei Arbeitern in diesen Fabriken vorgeschrieben. Inzwischen sind viele Mannjahre von ungeimpften Personen in Hochrisikoexpositionen zusammengekommen, aber nur 13 Fälle von Lungenmilzbrand wurden bekannt.¹⁹ ⁴⁴ In einer zur Exposition durchgeführten Untersuchung in Pennsylvania bei Ziegenhaarfabriken, wurde gezeigt, daß die Arbeiter bis zu 510 B. anthracis Partikel von mindestens 5 µm Durchmesser pro Person pro Achtstundenschicht einatmen. Diese Konzentrationen waren über den Zeitraum der Studie konstant in der Umgebung vorhanden⁴⁴, dennoch sind keine Fälle von Lungenmilzbrand aufgetreten.
Wissenschaftler der US-Armee haben Modellanalysen zur Risikoabschätzung einer sekundären Aerosolbildung erarbeitet. Eine Studie kam zu dem Ergebnis, das es weder durch Verkehr auf asphaltierten Straßen noch durch von Helikoptern oder Düsenflugzeugen benutzten Landebahnen ein signifikantes Risiko für Personen in Gebieten die mit 1 Million Sporen pro Quadratmeter kontaminiert sind gibt.⁶⁹ Eine andere Studie hat gezeigt, daß ein aktiv übender Soldat in Gegenden mit 20 Millionen Bacillus subtilis-Sporen pro Quadratmeter in einer 3-Stundenperiode zwischen 1.000 – 15.000 Sporen einatmen würde.⁷⁰
Es ist viel über die technische Problematik der Dekontamination einer mit Milzbrandsporen verseuchten Umgebung geschrieben worden. Als klassischer Fall hierfür gilt die Insel Gruinard in Großbritannien. Im Zweiten Weltkrieg hat das britische Militär auf dieser Insel vor der Küste Schottlands milzbrandsporenhaltige Explosivkörper getestet. Noch nach 36 Jahren nach Abschluß der Versuche konnten lebensfähige Sporen gefunden werden. Die Dekontaminierung der Insel erfolgte in Etappen zwischen 1979 und 1987, bis sie dann schließlich für völlig dekontaminiert erklärt worden ist. Die gesamten Kosten für diese Aktion wurden niemals veröffentlicht, aber unter dem benötigten Material befanden sich 280 t Formaldehyd und 2.000 t Seewasser¹⁷ ⁷¹
Wenn ein Ort erwiesenermaßen stark mit Milzbrandsporen kontaminiert ist könnte eine Dekontaminierung in der unmittelbaren Nähe der Verseuchung oder nahe des Freisetzungspunktes des Milzbrandaerosols das geringe Risiko einer Infektion durch sekundäre Aerosolisierung erhöhen. Jedoch ist die Dekontaminierung von großen städtischen Gegenden oder einem einzelnen Gebäude nach Kontakt mit einem milzbrandhaltigen Aerosol extrem schwierig und sollte daher besser unterbleiben. Obwohl das Infektionsrisiko durch ein sekundäres Aerosol extem klein ist, ist es dennoch nicht möglich ein Letztrisiko auszuschließen. Postexpositionelle Impfung, sofern ein Impfstoff zur Verfügung steht, könnte eine mögliche Maßnahme sein, um das Risiko einer Milzbrandinfektion in diesem Szenario weiter zu vermindern.
Im Falle einer angekündigten, vermeintlichen Freisetzung von Milzbrand, wie in einer Reihe von Falschmeldungen in vielen Teilen der USA im Jahre 1998 geschehen,⁴⁸ sollte jede Person die in direktem Kontakt mit einer milzbrandverdächtigen Substanz gekommen ist, die exponierten Hauststellen und Wäschestücke gründlich mit Wasser und Seife waschen.⁷² Eine weitergehende Dekontamination von direkt exponierten oder anderen Personen ist nicht angezeigt. Zusätzlich sollte jede Person, die mit der verdächtigen Substanz in Kontakt gekommen ist solange prophylaktisch antibiotisch behandelt werden, bis geklärt ist, ob es sich tatsächlich um Milzbrand handelt oder nicht. Sollte es ich bei der verdächtigen Substanz tatsächlich um Milzbrandsporen handeln sollten umgehend Experten des CDC oder des USAMRIID hinzugezogen werden.
Ausblick
Für eine effektive Antwort auf einen Anschlag eines Bioterroristen mit Milzbrand benötigt die medizinische Gemeinschaft weitere Kenntnisse über den Organismus, seine Genetik und Pathogenese, verbesserte diagnostische Techniken, verbesserte prophylaktische und therapeutische Möglichkeiten und verbesserte Impfstoffe der zweiten Generation.⁴⁷ Eine kürzlich veröffentlichte russische Studie an Nagern hat aufgezeigt, daß durch Gentransfer vom verwandten B. cereus B. anthracis in die Lage versetzt wird die schützende Wirkung des russischen Impfstoffes mit abgeschwächten Lebendkeimen zu unterlaufen.⁷³ Weitere Untersuchungen zur Rolle dieser Gene in Bezug auf die Virulenz und die Fähigkeit zum Unterlaufen der impfstoffinduzierten Immunität sind notwendig. Weiterhin muß ermittelt werden, welche Bedeutung diese Ergebnisse für die US-Vakzine haben. Es müssen verstärkte Anstrengungen in der Impfstoffentwicklung unternommen werden, die es den Herstellern erlauben verbesserte 2. Generation-Impfstoffe mit geringerer Dosierung herzustellen. Darüberhinaus sind auch weitere grundlegende Kenntnisse zur maximalen Inkubationszeit nach Inhalation von mit Sporen kontaminierten Aerosolen und zum Zeitpunkt der optimalen Gabe von Antibiotika nach Exposition erforderlich.
Autoren- & Artikelinformation
Autorenzuordnungen: The Center for Civilian Biodefense Studies (Drs Inglesby, Henderson, Bartlett, O’Toole, Perl, und Russell), and the Schools of Medicine (Drs Inglesby, Bartlett, und Perl) and Public Health (Drs Henderson, O’Toole, und Russell), Johns Hopkins University, Baltimore, Md; Viral and Rickettsial Diseases, California Department of Health, Berkeley (Dr. Ascher); US Army Medical Research Institute of Infectious Diseases, Frederick, Md (Drs Eitzen, Friedlander, und Parker); Office of Emergency Management, New York, NY (Mr Hauer); Centers for Disease Control and Prevention, Atlanta, Ga (Dr. McDade); Acute Disease Epidemiology, Minnesota Department of Health, Minneapolis (Dr. Osterholm); and the Office of Emergency Preparedness, Department of Health and Human Services, Rockville, Md (Dr. Tonat).
Korrespondenzautor und Sonderdrucke: Thomas V. Inglesby, MD, Johns Hopkins Center for Civilian Biodefense Studies, Johns Hopkins University, Candler Bldg, Suite 850, 111 Market Pl, Baltimore, MD 21202 (e-mail: tvi@jhmi.edu).
Ex Officio Teilnehmer in der Arbeitsgruppe zur zivilen Bioverteidigung: George Curlin, MD, National Institutes of Health, Bethesda, Md; Margaret Hamburg, MD, und William Raub, PhD, Office of Assistant Secretary for Planning und Evaluation, DHHS, Washington, DC; Robert Knouss, MD, Office of Emergency Preparedness, DHHS, Rockville, Md; Marcelle Layton, MD, Office of Communicable Disease, New York City Health Department, New York, NY; und Brian Malkin und Stuart Nightingale, MD, FDA, Rockville.
Finanzierung und Unterstützung: Diese Studie wurde primär von den Institutionen der beteiligten Autoren getragen. Daüberhinaus erstatte das Office of Emergency Preparedness (DHHS) die Reisekosten für vier Mitglieder der Gruppe.
Ausschlußklausel: In vielen Fällen stimmen die genannten Indikationen, Dosierungen und anderen Informationen nicht mit den gegenwärtigen Zulassungen durch die US Food und Drug Administration (FDA) überein. Die Empfehlungen zur Verwendung von Medikamenten und Impfstoffen, welche nicht von den Zulassungen der FDA entsprechen entspricht nicht der offiziellen Sichtweise der FDA oder der irgendeiner anderen Bundeseinrichtung von an der Diskussion teilnehmenden Wissenschaftlern. Die Empfehlungen zum von den Zulassungen abweichenden Gebrauch von Produkten ist in dem jeweiligen Abschnitt angemerkt, in dem die Produkte besprochen werden. Dort abweichender Gebrauch angezeigt ist, wird die zur Information auf Grund derer die Empfehlung erfolgt diskutiert.
Die in der vorliegenden Veröffentlichung enthaltenen Sichtweisen, Meinungen, Annahmen und Ergebnisse sind die der Autoren und sind nicht der Art auszulegen, als das sie Positionen, Richtlinien oder Entscheidungen des US-Verteidungsministeriums oder der US-Armee wiederspiegeln, es sei denn durch ausdrückliche Nennung in anderen Dokumentationen.
Weiterführende Artikel: Dieser Artikel ist der erste in einer Reihe mit dem Titel Medical und Public Health Management Following the Use of a Biological Weapon: Consensus Statements of the Working Group on Civilian Biodefense.
Danksagungen: Die Arbeitsgruppe möchte Jeanne Guillermin, PhD, Professor für Soziologie, Boston College, Boston, Mass., für ihre Kommentare zum Manuskript danken. Seit 1992 leitete Dr. Guillermin die Befragung zur Verifizierung der Daten zum Erkrankungsverlauf der Opfer von Sverdlovsk von 1979, welche in Anthrax, A Book of Names, California Press beschrieben werden werden. Ebenso danken wir Matthew Meselson, Timothy Townsend, MD, Martin Hugh-Jones, MA, VetMB, MPH, PhD, und Philip Brachman, MD, für die Durchsicht und die Komentare zum Manuskript.
Referenzen
- Carter A, Deutsch J, Zelicow P. Catastrophic terrorism. Foreign Aff. 1998, 77:80-95.
- Lew D. Bacillus anthracis (anthrax).In: Mandell GL, Bennett JE, Dolin R, eds. Principles und Practices of Infectious Disease.New York, NY: Churchill Livingstone Inc; 1995:1885-1889.
- Christopher GW, Cieslak TJ, Pavlin JA, Eitzen EM. Biological warfare: a historical perspective. JAMA 1997,278:412-417. MEDLINE
- Cole LA. The specter of biological weapons. Sci Am. December 1996:60-65.
- Zilinskas RA. Iraq’s biological weapons: the past as future? JAMA 1997, 278:418-424. MEDLINE
- Public Health Service Office of Emergency Preparedness. Proceedings of the Seminar on Responding to the Consequences of Chemical und Biological Terrorism. Washington, DC: US Dept of Health und Human Services; 1995
- WuDunn S, Miller J, Broad W. How Japan germ terror alerted world. New York Times May 26, 1998:1-6
- Meselson M, Guillemin J, Hugh-Jones M, et al. The Sverdlovsk anthrax outbreak of 1979. Science. 1994;266:1202-1208. MEDLINE
- World Health Organization. Health Aspects of Chemical und Biological Weapons. Geneva, Switzerland: World Health Organization; 1970:98-99
- Simon JD. Biological terrorism: preparing to meet the threat. JAMA 1997, 278:428-430. MEDLINE
- Cristy GA, Chester CV. Emergency Protection Against Aerosols. Oak Ridge, Tenn: Oak Ridge National Laboratory; 1981. Publication ORNL-5519
- Office of Technology Assessment, US Congress. Proliferation of Weapons of Mass Destruction. Washington, DC: US Government Printing Office; 1993, 53-55. Publication OTA-ISC-559
- Kaufmann AF, Meltzer MI, Schmid GP. The economic impact of a bioterrorist attack. Emerg Infect Dis. 1997;3:83-94. MEDLINE
- Kohout E, Sehat A, Ashraf M. Anthrax: a continuous problem in south west Iran. Am J. Med. Sci. 1964, 247:565
- Pienaar UV. Epidemiology of anthrax in wild animals und the control on anthrax epizootics in the Kruger National Park, South Africa. Fed. Proc. 1967, 26:1496-1591. MEDLINE
- Dragon DC, Rennie RP. The ecology of anthrax spores. Can. Vet. J. 1995, 36:295-301. MEDLINE
- Titball RW, Turnbull PC, Hutson RA. The monitoring und detection of Bacillus anthracis in the environment. J. Appl. Bacteriol. 1991, 70(suppl):9S-18S
- Brachman PS, Friedlander A. Anthrax. In: Plotkin SA, Orenstein WA, eds. Vaccines 3rd ed. Philadelphia, Pa: WB Saunders Co; 1999:629-637
- Brachman PS. Inhalation anthrax. Ann. N. Y. Acad. Sci. 1980, 353:83-93. MEDLINE
- Centers for Disease Control und Prevention. Summary of notifiable diseases, 1945-1994. MMWR Morb. Mortal Wkly. Rep. 1994, 43:70-78
- Myenye KS, Siziya S, Peterson D. Factors associated with human anthrax outbreak in the Chikupo und Ngandu villages of Murewa district in Mashonaland East Province, Zimbabwe. Cent. Afr. J. Med. 1996, 42:312-315. MEDLINE
- Tekin A, Bulut N, Unal T. Acute abdomen due to anthrax. Br. J. Surg. 1997, 84:813. MEDLINE
- Friedlander A. Anthrax. In: Zajtchuk R, Bellamy RF, eds. Textbook of Military Medicine: Medical Aspects of Chemical und Biological Warfare. Washington, DC: Office of the Surgeon General, US Dept of the Army; 1997:467-478
- Sirisanthana T, Nelson KE, Ezzell JW, Abshire TG. Serological studies of patients with cutaneous und oral-pharyngeal anthrax from northern Thailand. Am. J. Trop. Med. Hyg. 1988, 39:575-581. MEDLINE
- Kunanusont C, Limpakarnjanarat K, Foy HM. Outbreak of anthrax in Thailand. Ann. Trop. Med. Parasitol. 1989, 84:507-512
- Sirisanthana T, Navachareon N, Tharavichitkul P, Sirisanthana V, Brown AE. Outbreak of oral-pharyngeal anthrax. Am. J. Trop. Med. Hyg. 1984, 33:144-150. MEDLINE
- Dutz W, Saidi F, Kouhout E. Gastric anthrax with massive ascites. Gut 1970, 11:352-354. MEDLINE
- Friedlander A, Welkos SL, Pitt ML, et al. Postexposure prophylaxis against experimental inhalation anthrax. J. Infect. Dis. 1993, 167:1239-1242. MEDLINE
- Lincoln RE, Hodges DR, Klein F, et al. Role of the lymphatics in the pathogenesis of anthrax. J. Infect. Dis. 1965, 115:481-494. MEDLINE
- Williams RP. Bacillus anthracis und other spore forming bacilli. In: Braude AI, Davis LE, Fierer J, eds. Infectious Disease und Medical Microbiology. Philadelphia, Pa: WB Saunders Co; 1986:270-278
- Druett HA, Henderson DW, Packman L, Peacock S. Studies on respiratory infection. J. Hyg. 1953, 51:359-371
- Hatch TF. Distribution und deposition of inhaled particles in respiratory tract. Bacteriol. Rev. 1961, 25:237-240
- Ross JM. The pathogenesis of anthrax following the administration of spores by the respiratory route. J. Pathol. Bacteriol. 1957, 73:485-495
- Glassman HN. Industrial inhalation anthrax. Bacteriol. Rev. 1966, 30:657-659
- Henderson DW, Peacock S, Belton FC. Observations on the prophylaxis of experimental pulmonary anthrax in the monkey. J. Hyg. 1956, 54:28-36
- Smith H, Keppie J. Observations on experimental anthrax. Nature 1954, 173:869-870
- Defense Intelligence Agency. Soviet Biological Warfare Threat. Washington, DC: US Dept of Defense; 1986. Publication DST-161OF-057-86
- Amramova FA, Grinberg LM, Yampolskaya O, Walker DH. Pathology of inhalational anthrax in 42 cases from the Sverdlovsk outbreak in 1979. Proc. Natl. Acad. Sci. U S A. 1993, 90:2291-2294. MEDLINE
- Dalldorf F, Kaufmann AF, Brachman PS. Woolsorters‘ disease. Arch. Pathol. 1971, 92:418-426. MEDLINE
- Gleiser CA, Berdjis CC, Harman HA, Gochenour WS. Pathology of experimental respiratory anthrax in Macaca Mulatta. Br. J. Exp. Pathol. 1963, 44:416-426
- Franz DR, Jahrling PB, Friedlander A, et al. Clinical recognition und management of patients exposed to biological warfare agents. JAMA 1997, 278:399-411. MEDLINE
- Vessal K, Yeganehdoust J, Dutz W, Kohout E. Radiologic changes in inhalation anthrax. Clin Radiol. 1975, 26:471-474. MEDLINE
- Albrink WS, Brooks SM, Biron RE, Kopel M. Human inhalation anthrax. Am. J. Pathol. 1960, 36:457-471
- Dahlgren CM, Buchanan LM, Decker HM, et al. Bacillus anthracis aerosols in goat hair processing mills. Am. J. Hyg. 1960, 72:24-31
- Walker JS, Lincoln RE, Klein F. Pathophysiological und biochemical changes in anthrax. Fed. Proc. 1967, 26:1539-1544. MEDLINE
- Pile JC, Malone JD, Eitzen EM, Friedlander A. Anthrax as a potential biological warfare agent. Arch. Intern. Med. 1998, 158:429-434. MEDLINE
- Institute of Medicine National Research Council. Improving Civilian Medical Response to Chemical und Biological Terrorist Incidents. Washington, DC: National Academy Press; 1998:1-70
- Centers for Disease Control und Prevention. Bioterrorism alleging use of anthrax und interim guidelines for management — United States, 1998. MMWR Morb Mortal Wkly Rep. 1999, 48:69-74. MEDLINE
- Penn C, Klotz SA. Anthrax. In: Gorbach SL, Bartlett JG, Blacklow NR, eds. Infectious Diseases Philadelphia, Pa: WB Saunders Co; 1998:1575-1578
- Brachman PS. Anthrax. In: Hoeprich PD, Jordan MC, Ronald AR, eds. Infectious DiseasesPhiladelphia, Pa: JB Lippincott; 1994:1003-1008
- Anthrax vaccine, military use in Persian Gulf region [press release]. Washington, DC: US Dept of Defense; September 8, 1998
- Michigan Department of Public Health. AnthraxVaccine Absorbed Lansing: Michigan Dept of Public Health; 1978
- Brachman PS, Gold H, Plotkin SA, Fekety FR, Werrin M, Ingraham NR. Field evaluation of human anthrax vaccine. Am. J. Public Health. 1962, 2:632-645
- Ivins BE, Fellows P, Pitt ML, et al. Efficacy of standard human anthrax vaccine against Bacillus anthracis aerosol spore challenge in rhesus monkeys. Salisbury Med. Bull. 1996, 87:125-126
- Turnbull PC. Anthrax vaccines: past, present und future. Vaccine. 1991, 9:533-539. MEDLINE
- Barnes JM. Penicillin und B anthracis. J. Pathol. Bacteriol. 1947, 194:113-125
- Lincoln RE, Klein F, Walker JS, et al. Successful treatment of monkeys for septicemic anthrax. In: Antimicrobial Agents und Chemotherapy — 1964Washington, DC: American Society for Microbiology 1965: 759-763
- Odendaal MW, Peterson PM, de Vos V, Botha AD. The antibiotic sensitivity patterns of Bacillus anthracis isolated from the Kruger National Park. Onderstepoort J. Vet. Res. 1991, 58:17-19. MEDLINE
- Doganay M, Aydin N. Antimicrobial susceptibility of Bacillus anthracis. Scand. J. Infect. Dis. 1991, 23:333-335
- American Hospital Formulary Service. AHFS Drug Information. Bethesda, Md: American Society of Health System Pharmacists; 1996
- Kelly D, Chulay JD, Mikesell P, Friedlander A. Serum concentrations of penicillin, Doxyzyklin, und ciprofloxacin during prolonged therapy in rhesus monkeys. J. Infect. Dis. 1992, 166:1184-1187. MEDLINE
- Stepanov AV, Marinin LI, Pomerantsev AP, Staritsin NA. Development of novel vaccines against anthrax in man. J. Biotechnol. 1996, 44:155-160. MEDLINE
- Schaad UB, Abdus Salam M, Aujard Y, et al. Use of fluoroquinolones in pediatrics. Pediatr. Infect. Dis. J. 1995, 14:1-9. MEDLINE
- Lightfoot NF, Scott RJ, Turnbull PC. Antimicrobial susceptibility ofBacillus anthracis: proceedings of the international workshop on anthrax. Salisbury Med. Bull. 1990, 68:95-98
- Perkins WA. Public health implications of airborne infection. Bacteriol. Rev. 1961;25:347-355
- American Public Health Association. Anthrax. In: Benenson AS, ed. Control of Communicable Diseases ManualWashington, DC: American Public Health Association 1995, 18-22
- Morse S, McDade J. Recommendations for working with pathogenic bacteria. Methods Enzymol. 1994, 235:1-26. MEDLINE
- Guillermin J. Anthrax: The Investigation of a Lethal Outbreak. Berkeley: University of California Press. In press.
- Chinn KS. Reaerosolization Hazard Assessment for Biological Agent-Contaminated Hardstand Areas. Life Sciences Division, Dugway Proving Ground, Utah: US Dept of the Army, 1996:1-40. Publication DPG/JCP-96/012
- Resnick IG, Martin DD, Larsen LD. Evaluation of Need for Detection of Surface Biological Agent Contamination. Dugway Proving Ground, Life Sciences Division, US Dept of the Army, 1990:1-35. Publication DPG-FR-90-711
- Manchee RJ, Stewart WD. The decontamination of Gruinard Island. Chem. Br. July 1988, 690-691
- US Army Medical Research Institute of Infectious Diseases, Centers for Disease Control und Prevention, und US Food und Drug Administration. Medical Response to Biological Warfare und Terrorism. Gaithersburg, Md: US Army Medical Research Institute of Infectious Diseases, Centers for Disease Control und Prevention, und US Food und Drug Administration; 1998
- Pomerantsev AP, Staritsin NA, Mockov YV, Marinin LI. Expression of cereolysine AB genes in Bacillus anthracis vaccine strain ensures protection against experimental hemolytic anthrax infection. Vaccine 1997, 15:1846-1850. MEDLINE